Si quieres explicar por qué vuela un avión, todo es cuestión de Física. La explicación la encontramos en las Fuerzas, y, sobre todo, en la Fuerza de Sustentación. A continuación tienes las explicaciones:
31 may 2017
25 may 2017
Recursos y simulaciones Fuerzas y movimiento
Acciendo clic en los enlaces podrás acceder a los siguientes recursos:
FUERZAS Y MOVIMIENTOS: FUNDAMENTOS
VÍDEOS: DEFORMACIONES Y ELASTICIDAD: ENLACE AQUÍ
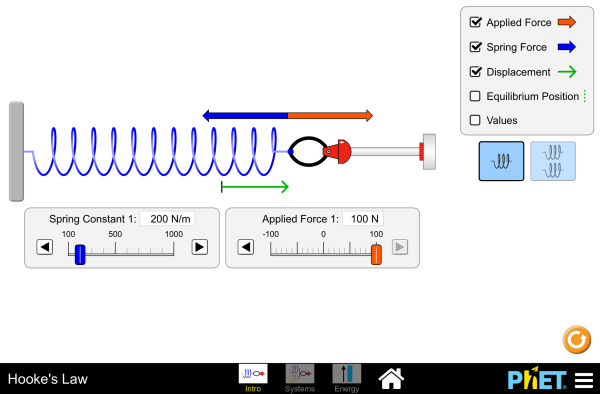
LABORATORIO VIRTUAL: LEY DE HOOKE
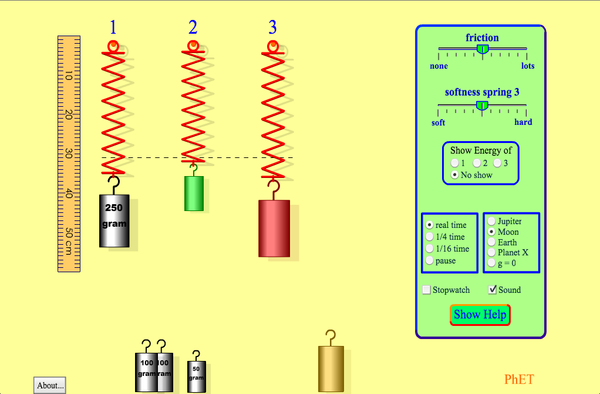
OTRA SIMULACIÓN DE MASAS Y MUELLES
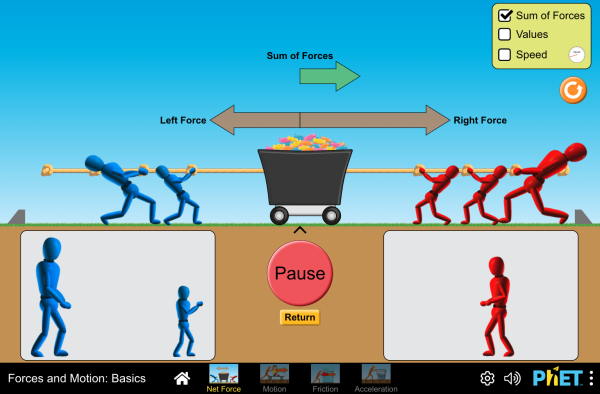
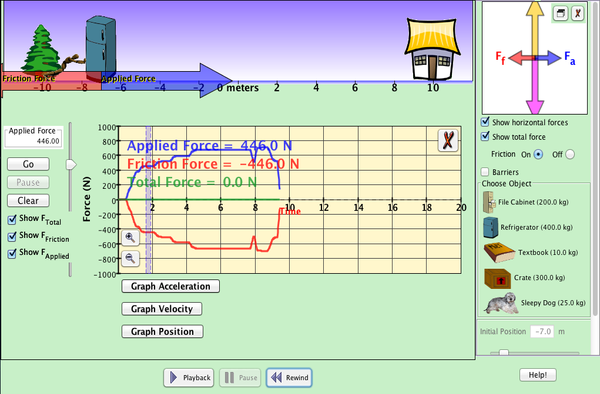
RELACIÓN FUERZAS Y MOVIMIENTO
TE ATREVES A ATERRIZAR UNA NAVE EN LA LUNA
FUERZAS Y MOVIMIENTOS: FUNDAMENTOS
VÍDEOS: DEFORMACIONES Y ELASTICIDAD: ENLACE AQUÍ
LABORATORIO VIRTUAL: LEY DE HOOKE
OTRA SIMULACIÓN DE MASAS Y MUELLES
RELACIÓN FUERZAS Y MOVIMIENTO
TE ATREVES A ATERRIZAR UNA NAVE EN LA LUNA
24 may 2017
UD 5 Tarea 1 Identificamos fuerzas en situaciones cotidianas y sus efectos: deformaciones y movimientos
Vamos a empezar a estudiar la unidad por entender qué son las fuerzas, qué efectos producen y cómo se pueden medir. Para empezar debes entender qué la fuerza es una magnitud física que explica una interacción entre DOS CUERPOS. Es decir, nunca podrás decir físicamente que un cuerpo tiene mucha fuerza. Esta magnitud se mide, en el Sistema Internacional, en Newton (N), de forma que 9,8 N= 1 kg
Estudiarás esta tarea siguiendo los contenidos del libro de texto, en las páginas 138, 139, 140, 141 y 142.
REALIZA LAS SIGUIENTES ACTIVIDADES EN TU CUADERNO CON AYUDA DEL LIBRO Y DEL BLOG DE AULA
A1. Las FUERZAS se producen entre dos cuerpos. De esta manera, podemos distinguir fuerzas por contacto y fuerzas a distancia. ¿Cuáles son los dos principales efectos que producen ambos tipos de fuerzas?
A2.- Al aplicar una fuerza sobre un cuerpo, el efecto varía en función de una serie de características. Piensa en una bola de billar, al golpearla y responde: qué características son las que permiten definir una fuerza (esas características son los que definen un vector)
A3.- La FUERZA es, por tanto ,una magnitud vectorial. Esto quiere decir que si aplicamos varias fuerzas a un cuerpo, la suma de todas ellas constituyen lo que se llama FUERZA RESULTANTE. Si aplicamos dos fuerzas a un cuerpo, una de 50 N y otra de 30 N, ¿por qué podemos decir que la suma de ambas fuerzas no tiene por qué ser 80 N?
A4.- Haz los siguientes ejercicios número 7 y 8 del libro de texto (páginas 138 y 139)
A5.- Efectos de las fuerzas: Deformaciones. Muchas veces, las fuerzas producen deformaciones en los cuerpos. Según el comportamiento del cuerpo que recibe la fuerza, hay tres tipos de cuerpos. ¿Sabrías definirlos?
A6.- Sabiendo que una fuerza produce una deformación sobre un muelle o un cuerpo elástico, Robert Hooke estableció en 1660 la llamada LEY DE HOOKE: ¿Qué dice dicha ley?
A7.- Vamos a comprobar experimentalmente la ley de Hooke. También podemos hacer el experimento virtual.
A8.- Las fuerzas producen cambios en el movimiento de los cuerpos.
a) El rozamiento es una fuerza que siempre se opone al movimiento. Es responsable, por ejemplo, de que podamos andar o correr. Indica tres situaciones en las que el rozamiento sea beneficioso y otras tres situaciones donde sea perjudicial.
b) Te has preguntado alguna vez por qué caen los objetos. Observará además que en la caída, la velocidad va en aumento. ¿Qué fuerza produce la caída de los cuerpos? ¿Qué características tiene esta fuerza?
A9.- Una de las consecuencias de la fuerza de gravedad es la fuerza peso. El peso se define como P= m·g, donde g es la gravedad terrestre en la superficie, g= 9,8 m/s2.
INVESTIGA: ¿Qué llegará al suelo antes, una hoja de papel o una goma?
A10.- INVESTIGA: ¿Por qué vuela un avión?
Estudiarás esta tarea siguiendo los contenidos del libro de texto, en las páginas 138, 139, 140, 141 y 142.
REALIZA LAS SIGUIENTES ACTIVIDADES EN TU CUADERNO CON AYUDA DEL LIBRO Y DEL BLOG DE AULA
A1. Las FUERZAS se producen entre dos cuerpos. De esta manera, podemos distinguir fuerzas por contacto y fuerzas a distancia. ¿Cuáles son los dos principales efectos que producen ambos tipos de fuerzas?
A2.- Al aplicar una fuerza sobre un cuerpo, el efecto varía en función de una serie de características. Piensa en una bola de billar, al golpearla y responde: qué características son las que permiten definir una fuerza (esas características son los que definen un vector)
A3.- La FUERZA es, por tanto ,una magnitud vectorial. Esto quiere decir que si aplicamos varias fuerzas a un cuerpo, la suma de todas ellas constituyen lo que se llama FUERZA RESULTANTE. Si aplicamos dos fuerzas a un cuerpo, una de 50 N y otra de 30 N, ¿por qué podemos decir que la suma de ambas fuerzas no tiene por qué ser 80 N?
A4.- Haz los siguientes ejercicios número 7 y 8 del libro de texto (páginas 138 y 139)
A5.- Efectos de las fuerzas: Deformaciones. Muchas veces, las fuerzas producen deformaciones en los cuerpos. Según el comportamiento del cuerpo que recibe la fuerza, hay tres tipos de cuerpos. ¿Sabrías definirlos?
A6.- Sabiendo que una fuerza produce una deformación sobre un muelle o un cuerpo elástico, Robert Hooke estableció en 1660 la llamada LEY DE HOOKE: ¿Qué dice dicha ley?
A7.- Vamos a comprobar experimentalmente la ley de Hooke. También podemos hacer el experimento virtual.
A8.- Las fuerzas producen cambios en el movimiento de los cuerpos.
a) El rozamiento es una fuerza que siempre se opone al movimiento. Es responsable, por ejemplo, de que podamos andar o correr. Indica tres situaciones en las que el rozamiento sea beneficioso y otras tres situaciones donde sea perjudicial.
b) Te has preguntado alguna vez por qué caen los objetos. Observará además que en la caída, la velocidad va en aumento. ¿Qué fuerza produce la caída de los cuerpos? ¿Qué características tiene esta fuerza?
A9.- Una de las consecuencias de la fuerza de gravedad es la fuerza peso. El peso se define como P= m·g, donde g es la gravedad terrestre en la superficie, g= 9,8 m/s2.
INVESTIGA: ¿Qué llegará al suelo antes, una hoja de papel o una goma?
A10.- INVESTIGA: ¿Por qué vuela un avión?
22 may 2017
Materiales que han cambiado nuestras vidas
En la actividad 20, te pedía lo siguiente: En el libro, en la página 118, hay una línea del tiempo en la que se nombran algunos materiales que han transformado nuestras vidas. Localiza información sobre los siguientes materiales, e indica cómo ha contribuido a mejorar nuestras vidas:
a) Acero. b) Baquelita. c) Nylon. d) Teflón. e) Grafeno.
En la Wikipedia podrás obtener información de estos materiales_
18 may 2017
Reacciones químicas en nuestro entorno
Accede a los siguientes enlaces y obtendrás información de cómo las reacciones químicas mejoran nuestras vidas.
EL FUNCIONAMIENTO DE LA PILA DE CINC-CARBONO VIDEO PILA SECA
LA LEJÍA: QUÉ ES Y COMO ACTÚA
ALGUNAS REACCIONES QUÍMICAS EN LA COCINA
MAS SOBRE REACCONES QUÍMICAS EN LA COCINA
COMBUSTIÓN DEL BUTANO VÍDEO: COMBUSTIÓN DEL BUTANO
EL FUNCIONAMIENTO DE LA PILA DE CINC-CARBONO VIDEO PILA SECA
LA LEJÍA: QUÉ ES Y COMO ACTÚA
ALGUNAS REACCIONES QUÍMICAS EN LA COCINA
MAS SOBRE REACCONES QUÍMICAS EN LA COCINA
COMBUSTIÓN DEL BUTANO VÍDEO: COMBUSTIÓN DEL BUTANO
14 may 2017
Vídeos: La Química en nuestras vidas
Observa los siguientes vídeos:
UN DÍA SIN QUÍMICA
APLICACIONES DE LA QUÍMICA A LA VIDA DIARIA
LA QUÍMICA Y LA VIDA
UN DÍA SIN QUÍMICA
APLICACIONES DE LA QUÍMICA A LA VIDA DIARIA
LA QUÍMICA Y LA VIDA
MÁS VÍDEOS: LA QUÍMICA Y NOSOTROS: HAZ CLIC AQUÍ
Tarea 4 La Química en nuestras vidas y su impacto ambiental
Desde el descubrimiento del fuego hasta nuestros días, la química ha cambiado nuestras vidas. Esta tarea te permitirá estudiar cómo ha cambiado la sociedad. Pero además, podrás conocer que también la química origina importantes impactos en el medio ambiente. Conocer estos impactos y reducirlos o prevenirlos es nuestra meta.
ACTIVIDAD 19.- ¿Te imaginas vivir sin química? Observa los siguientes vídeos. Trata de tomar nota de sus contenidos y, posteriormente, organizamos un debate sobre la importancia de la química en nuestra sociedad.
ACTIVIDAD 20.- En el libro, en la página 118, hay una línea del tiempo en la que se nombran algunos materiales que han transformado nuestras vidas. Localiza información sobre los siguientes materiales, e indica cómo ha contribuido a mejorar nuestras vidas:
a) Acero. b) Baquelita. c) Nylon. d) Teflón. e) Grafeno.
ACTIVIDAD 21.- Busca y elige una NOTICIA sobre la aportación de la química a nuestra sociedad. Para ello, investiga en los siguientes campos: medicina y fármacos, cosmética e higiene, alimentación, agricultura o nuevos materiales. Coméntala en clase.
ACTIVIDAD 22.- LA QUÍMICA Y SU IMPACTO EN EL MEDIO AMBIENTE: Utilizando las infografías del libro, en las páginas 120, 121, 122 y 123, haz un resumen de los siguientes impactos de la química en nuestro medio ambiente:
a) La lluvia ácida: qué es, qué efecto produce, qué consecuencias tiene y cómo se puede solucionar el problema.
b) El efecto invernadero: cuál es el origen, qué efectos produce en la naturaleza y cómo se puede afrontar el problema.
c) Los clorofluorocarbonos (CFC): qué son, qué efectos produce en el medio y consecuencias y cómo se puede solucionar.
d) Los residuos industriales: señala los principales residuos industriales y cómo se puede solucionar los problemas qué genera.
e) INVESTIGA: ¿Qué principales problemas existen en La Palma debido a la Química?
10 may 2017
Las reacciones químicas pueden generar electricidad
Vamos a ver en sendos vídeos como podemos crear electricidad con las papas o con limones. Observa ambos vídeos y saca tus conclusiones.
Y ahora observemos con dos limones
9 may 2017
Se comprueba la ley de conservación de la masa: reacción del bicarbonato de sodio y el vinagre
En el vídeo podrás observar cómo se realiza el experimento. Sin embargo, añadimos algo importante, que es PESAR. Pesaremos todo ANTES. Y cuando se produzca la reacción, volvemos a pesar.
Reacciones químicas en el laboratorio: identificamos productos
Vemos en vídeo algunas reacciones químicas que hemos realizado en el laboratorio.
DETECTANDO EL DIÓXIDO DE CARBONO, CO2
En esta reacción quimica detectamos un producto de reacción, el díóxido de carbono.
En el matraz hay agua de cal, que se ha hecho con hidróxido de calcio (Ca(OH)2).
La disolución tiene un pH básico. Pero al soplar, estamos añdiendo CO2 al agua y ocurre esta reacción: CO2 + Ca(OH)2 ---------> CaCO3 + H2O
El carbonato de calcio CaCO3 es poco soluble en agua, y por ello, la disolución se vuelve turbia. Pero además, el pH se vuelve ácido, porque también se forma ácido carbónico, H2CO3
PASTA DE DIENTES DE ELEFANTE: DESCOMPOSICIÓN CATÁLITICA DEL PERÓXIDO DE HIDRÓGENO H2O2
En esta reacción química, el agua oxigenada o peróxido de hidrógeno, H2O2, se descomponen, en agua y oxígeno: H2O2 ---------> H2O + O2
El O2, oxígeno, con el fairy, provoca la espuma. El yoduro de potasio, KI, es un catlizador, provocando que la reacción transcurra más rápido.
PRODUCCIÓN DE HIDRÓGENO
La reacción es ÁCIDO CLORHÍDRICO + CINC PARA PRODUCIR HIDRÓGENO Y CLORURO DE CINC. En lenguaje químico sería: 2 HCl + Zn --------> ZnCl2 + H2
El Hidrógeno es explosivo. Por eso, en las burbujas hay hidrógeno, que explota.
"LLUVIA DE ORO": REACCIÓN ENTRE YODURO DE POTASIO Y NITRATO DE PLOMO(II)
La reacción se explica escribiendo la ecuación: 2 KI + Pb(NO3)2 --------> PbI2 + 2 KNO3
La sustancia amarilla que se observa es un precipitado de yoduro de plomo (PbI2). Luego, al calentar la disolución, gran parte del PbI2 pasa a la disolución. Y al enfriar esta disolución, el proceso es lento y se vuelve a forma yoduro de plomo, pero en este caso, en forma de cristales dorados.
DETECTANDO EL DIÓXIDO DE CARBONO, CO2
En esta reacción quimica detectamos un producto de reacción, el díóxido de carbono.
En el matraz hay agua de cal, que se ha hecho con hidróxido de calcio (Ca(OH)2).
La disolución tiene un pH básico. Pero al soplar, estamos añdiendo CO2 al agua y ocurre esta reacción: CO2 + Ca(OH)2 ---------> CaCO3 + H2O
El carbonato de calcio CaCO3 es poco soluble en agua, y por ello, la disolución se vuelve turbia. Pero además, el pH se vuelve ácido, porque también se forma ácido carbónico, H2CO3
PASTA DE DIENTES DE ELEFANTE: DESCOMPOSICIÓN CATÁLITICA DEL PERÓXIDO DE HIDRÓGENO H2O2
En esta reacción química, el agua oxigenada o peróxido de hidrógeno, H2O2, se descomponen, en agua y oxígeno: H2O2 ---------> H2O + O2
El O2, oxígeno, con el fairy, provoca la espuma. El yoduro de potasio, KI, es un catlizador, provocando que la reacción transcurra más rápido.
PRODUCCIÓN DE HIDRÓGENO
La reacción es ÁCIDO CLORHÍDRICO + CINC PARA PRODUCIR HIDRÓGENO Y CLORURO DE CINC. En lenguaje químico sería: 2 HCl + Zn --------> ZnCl2 + H2
El Hidrógeno es explosivo. Por eso, en las burbujas hay hidrógeno, que explota.
"LLUVIA DE ORO": REACCIÓN ENTRE YODURO DE POTASIO Y NITRATO DE PLOMO(II)
La reacción se explica escribiendo la ecuación: 2 KI + Pb(NO3)2 --------> PbI2 + 2 KNO3
La sustancia amarilla que se observa es un precipitado de yoduro de plomo (PbI2). Luego, al calentar la disolución, gran parte del PbI2 pasa a la disolución. Y al enfriar esta disolución, el proceso es lento y se vuelve a forma yoduro de plomo, pero en este caso, en forma de cristales dorados.
Tarea 3.- La importancia de las reacciones químicas
Si ya sabes qué es una reacción química, ahora entenderás mejor qué son reactivos y productos, y cómo tenemos que representar una reacción química mediante ecuaciones químicas.
También podrás conocer qué es una reacción endotérmica y exotérmica, y cómo las reacciones pueden ser rápidas o lentas.
Para ello, estudiarás en el libro desde las páginas 108 hasta 115. Y realizaremos experimentalmente más reacciones químicas.
También podrás conocer qué es una reacción endotérmica y exotérmica, y cómo las reacciones pueden ser rápidas o lentas.
Para ello, estudiarás en el libro desde las páginas 108 hasta 115. Y realizaremos experimentalmente más reacciones químicas.
ACTIVIDAD 14.- ¿ A qué denominamos ecuación química? Para escribir una ecuación química deberás conocer las fórmulas de las sustancias que intervienen en una reacción, algo que este curso no se estudia. Sin embargo, sí podrás reconocer qué son los reactivos y productos, y representar las moléculas o sustancias. Observa estas dos reacciones, e indica cuáles son los reactivos y cuáles los productos (página 108) representando las ecuaciones químicas mediante modelos moleculares:
a) Combustión del metano: CH4 + 2 O2 → CO2 + 2 H2O
a) Combustión del metano: CH4 + 2 O2 → CO2 + 2 H2O
b) Formación del amoníaco: N2 + 3 H2 → 2 NH3
ACTIVIDAD 15.- En una reacción química, la masa de los reactivos es igual a la masa de los productos
a) Comprobamos experimentalmente la Ley de Conservación de la masa, haciendo el experimento que figura en el libro (página 111)
Ponemos en un vidrio reloj 1 g de bicarbonato de sodio y en un matraz erlenmeyer 5 mL de vinagre. Lo pesamos (….). Luego añadimos el bicarbonato al vinagre y lo volvemos a pesar (…).
Repetimos el experimento, pero ahora ponemos el bicarbonato dentro de un globo, que luego pondremos en la boca del matraz, sin verter el bicarbonato. Se pesa (…). Posteriormente se vierte el bicarbonato al vinagre Se deja que el globo se infle y se pesa (…).
¿Qué permite deducir el resultado del experimento?
ACTIVIDAD 16.- Reacciones endotérmicas y exotérmicas
a) ¿Cómo se llaman las reacciones que desprenden calor? Veremos un ejemplo.
b) ¿Cómo se llaman las reacción que absorben calor? Veremos un ejemplo.
ACTIVIDAD 17.- Identificamos reacciones lentas o rápidas
Las reacciones químicas pueden transcurrir de forma lenta o rápida. Es lo que se llama velocidad de reacción. Para que una reacción sea rápida, va a depender de varios factores. Por ejemplo, la descomposición del agua oxigenada, H2O es lenta, pero si le añadimos dióxido de manganeso, la reacción transcurre de forma rápida.
ACTIVIDAD 18.- Las reacciones químicas transcurren en nuestro entorno. Investiga:
a) ¿Por qué al cocinar los alimentos se producen reacciones químicas?
b) Al utilizar butano o propano para producir fuego estamos creando una reacción química que se denomina reacción de………..
ca) Las pilas y baterías contienen unas sustancias que al reaccionar producen corriente eléctrica. Puedes ver cómo podemos hacer una pila de un limón o de una papa. Averigua cómo funciona una pila normal de cinc.
d) Muchos productos de limpieza funcionan porque producen una reacción química. ¿Cómo actúa la lejía?
ACTIVIDAD 15.- En una reacción química, la masa de los reactivos es igual a la masa de los productos
a) Comprobamos experimentalmente la Ley de Conservación de la masa, haciendo el experimento que figura en el libro (página 111)
Ponemos en un vidrio reloj 1 g de bicarbonato de sodio y en un matraz erlenmeyer 5 mL de vinagre. Lo pesamos (….). Luego añadimos el bicarbonato al vinagre y lo volvemos a pesar (…).
Repetimos el experimento, pero ahora ponemos el bicarbonato dentro de un globo, que luego pondremos en la boca del matraz, sin verter el bicarbonato. Se pesa (…). Posteriormente se vierte el bicarbonato al vinagre Se deja que el globo se infle y se pesa (…).
¿Qué permite deducir el resultado del experimento?
ACTIVIDAD 16.- Reacciones endotérmicas y exotérmicas
a) ¿Cómo se llaman las reacciones que desprenden calor? Veremos un ejemplo.
b) ¿Cómo se llaman las reacción que absorben calor? Veremos un ejemplo.
ACTIVIDAD 17.- Identificamos reacciones lentas o rápidas
Las reacciones químicas pueden transcurrir de forma lenta o rápida. Es lo que se llama velocidad de reacción. Para que una reacción sea rápida, va a depender de varios factores. Por ejemplo, la descomposición del agua oxigenada, H2O es lenta, pero si le añadimos dióxido de manganeso, la reacción transcurre de forma rápida.
ACTIVIDAD 18.- Las reacciones químicas transcurren en nuestro entorno. Investiga:
a) ¿Por qué al cocinar los alimentos se producen reacciones químicas?
b) Al utilizar butano o propano para producir fuego estamos creando una reacción química que se denomina reacción de………..
ca) Las pilas y baterías contienen unas sustancias que al reaccionar producen corriente eléctrica. Puedes ver cómo podemos hacer una pila de un limón o de una papa. Averigua cómo funciona una pila normal de cinc.
d) Muchos productos de limpieza funcionan porque producen una reacción química. ¿Cómo actúa la lejía?
3 may 2017
Simulaciones: reacciones químicas
Accede a los siguientes enlaces y podrás estudiar las características de las reacciones químicas:
¿Qué es una reacción química?
¿Qué ocurre en una reacción química?
¿Cómo transcurre una reacción química? (esta simulación es de mayor nivel)
¿Qué es una reacción química?
¿Qué ocurre en una reacción química?
¿Cómo transcurre una reacción química? (esta simulación es de mayor nivel)
Suscribirse a:
Entradas (Atom)